马来西亚医疗器械监管,马来西亚目前是东盟主要国家之一,进口的医疗器械大部分用于国内使用。医疗器械管理局(MDA)于2012年6月成立,并于2013年7月开始自愿注册。2016年7月1日,过渡期结束,《第737号医疗器械法》全面实施。产品在马来西亚供应之前,必须经过马来西亚**防部的批准。马来西亚监管框架以IMDRF(以前称为GHTF)为基础,因此在马来西亚有可用的应用程序基准路线。
马来西亚医疗器械注册与审批:
包括IVD在内的医疗器械分为4类,即:
·A类(低风险)
·B类(中低风险)
·C类(高中)
·D类(高风险)
所有进口和供应(在马来西亚或再出口)的医疗器械,无论其风险分类如何(除非免于产品注册),都必须符合以下标准之一:
获得确认函;列入医疗器械注册;或通过其中一条授权路线授权。一般来说,A类、B类、C类和D类医疗器械必须在马来西亚市场供应之前向MDA注册。马来西亚也允许将产品分组为单个、系列、系统、集合、IVD测试套件或IVD集群。
产品注册档案必须按照东盟共同提交档案模板(CSDT)编制。

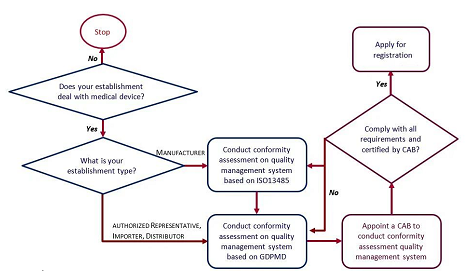
申请公司必须是当地实体,也称为当地授权代表。我司可以帮助提交申请,但需要得到产品所有者的授权。
海外制造商应指定具有GDPMD设立许可证的本地进口商和经销商。当地进口商和经销商应从MDA认可的认可认证机构获得GDPMD认证。
在马来西亚的本地制造商,可以向MDA提交产品注册,并拥有ISO 13485认证的建立许可证。我司可以帮助建立ISO 13485认证程序,并协助建立许可证申请。
合格评定(验证途径或全面评价途径)
如果产品已在至少一个GHTF创始成员国进行评估并获得市场许可,则可通过验证进行合格评定。否则,医疗器械必须通过申请的全面评价途径进行合格评定。
合格评定由称为合格评定机构的第三方独立机构进行,类似于欧洲的公告机构概念。必须是经MDA认可的认证机构。